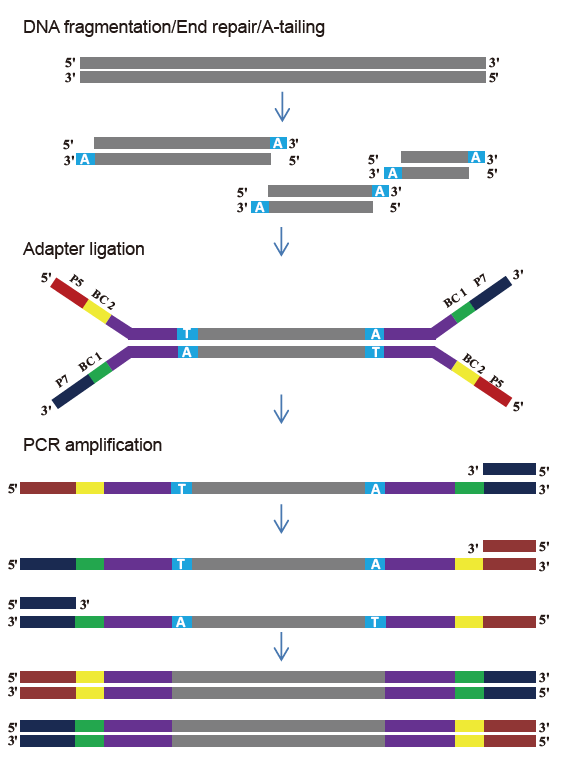
TIANSeq DirectFast bibliotečki komplet (ilumina)
Karakteristike
■ Dobra uniformnost sekvenciranja: Nema pristrasnosti baze procesa fragmentacije DNK i procesa amplifikacije PCR -a.
■ Visoka efikasnost konverzije biblioteke: konstrukcija biblioteke visoke efikasnosti može se osigurati za uzorke DNK od 1 ng.
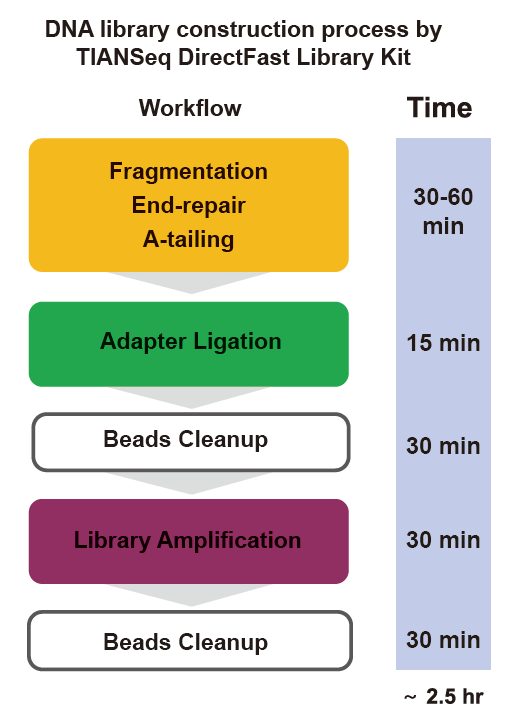
■ Brz rad: Cijelom procesu izgradnje biblioteke potrebno je samo 2,5 sata.
■ Ekonomično: Nisu potrebni posebni instrumenti i oprema。
Specifikacija
Tip: Priprema DNK biblioteke za visokopropusnu platformu za sekvenciranje ilumina
Uzorak: Genomska DNK ili DNK velikog fragmenta
Cilj: Dvolančana DNK
Početni unos uzorka: 1 ng- 1 μg
Vrijeme rada: 2,5 sata
Nizvodne aplikacije: Sekvenciranje na platformi illumina
Svi proizvodi se mogu prilagoditi za ODM/OEM. Za detalje,kliknite Prilagođena usluga (ODM/OEM)
Fleksibilan unos uzorka i fragmentirana veličina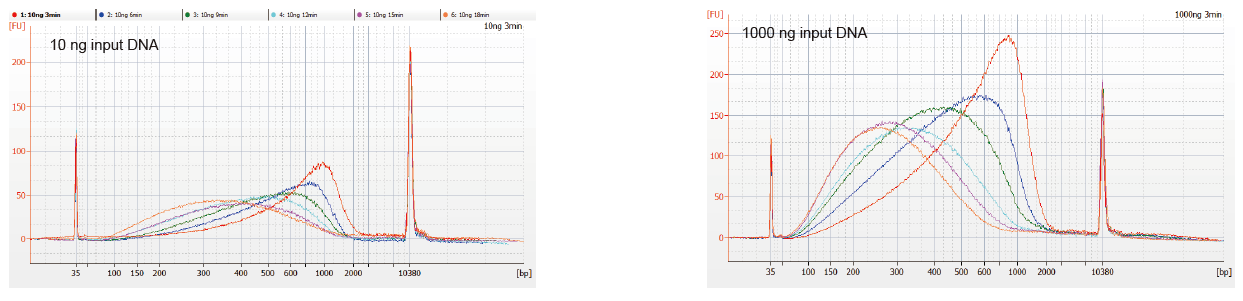 |
Slika 1. Profili fragmentacije DNK različitog vremena reakcije. DNK od 10 ng i 1000 ng je fragmentiran korištenjem TIANSeq DirectFast DNA Library Kit. Produkti reakcije tretirani s različitim vremenom reakcije pročišćeni su 1,8 × Ampure XP magnetnim zrncima i analizirani pomoću Angilent 2100. |
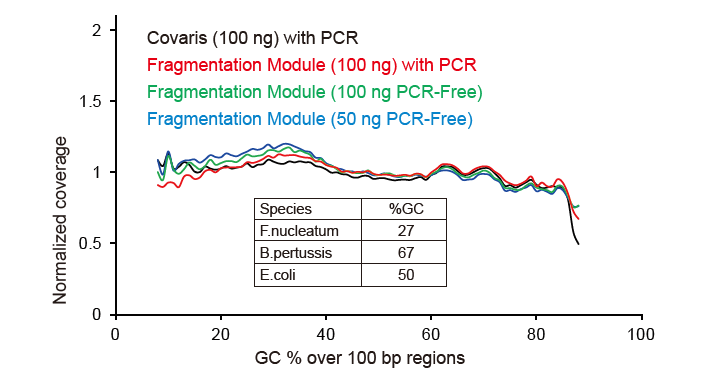
Pokrivenost sekvencioniranja slična Covarisu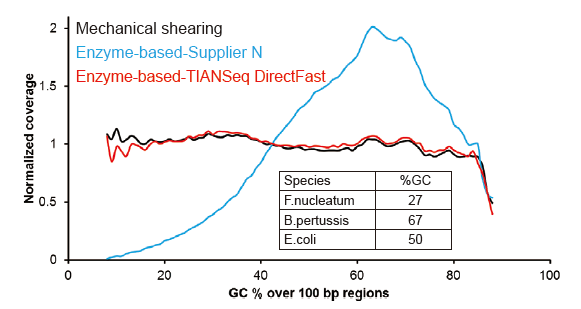 |
Slika 2. Usporedba pokrivenosti genoma različitim metodama pripreme biblioteke. Tri bakterijske genomske DNK sa različitim sadržajem GC su pomiješane ekvimolarne, te je upoređeno rezultiranje pokrivanjem genoma 100 ng mješovitih biblioteka DNK pomoću ovih metoda. Rezultati pokazuju da bibliotečki komplet TIANSeq DirectFast ima isti učinak na fragmentaciju DNK kao i mehaničko smicanje, te ne postoji osnovna predrasuda za fragmentaciju. |
Nema sistematske pristranosti za samo 1 ng ulazne DNK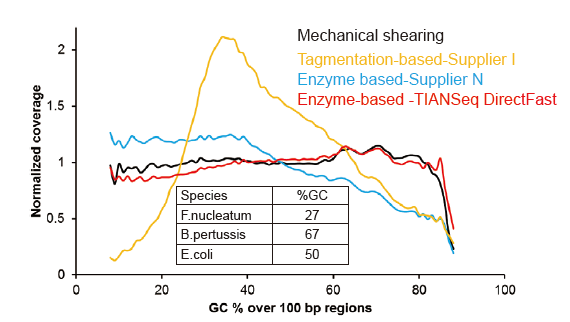 |
Slika 3. Usporedba pokrivenosti genoma različitim metodama pripreme biblioteke. Tri bakterijske genomske DNK s različitim sadržajem GC -a su pomiješane ekvimolarne, pa je upoređen rezultat pokrivanja genoma sekvenciranja 1 ng mješovitih biblioteka DNK pomoću ovih metoda. Rezultati pokazuju da TIANSeq DirectFast bibliotečki komplet ima dosljedan učinak fragmentacije s mehaničkim smicanjem čak i za unos DNK od samo 1 ng, te ne postoji pristranost baze. |
| Mogućnost tijeka rada bez PCR-a
|
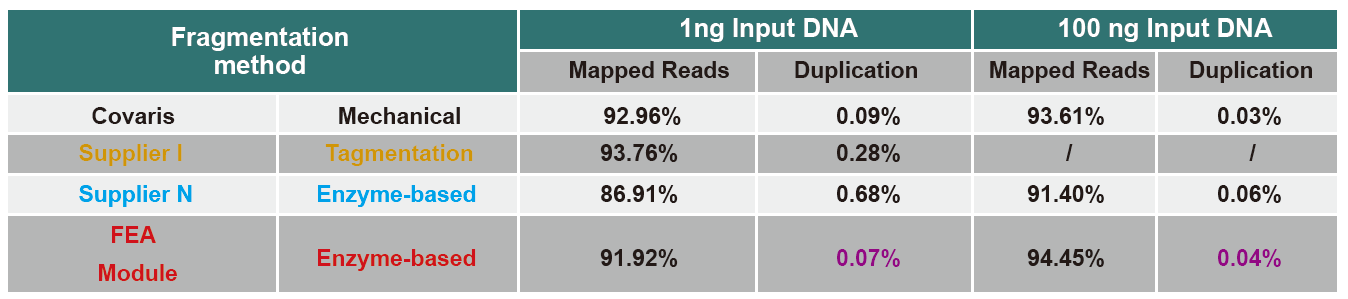
Slika 4. Za izradu biblioteke korištenjem različitih PCR ili PCR konstrukcija korišteni su različiti ulazi genomske DNK, te su upoređeni rezultati obuhvata genoma. Rezultati pokazuju da s radom s jednom cijevi i efikasnim koracima izgradnje biblioteke, DNK biblioteka konstruirana s TIANSeq DirectFast Library Kit održava visoku konzistentnost s mehaničkim smicanjem u distribuciji pokrivenosti sekvence fragmenata za oba toka rada obogaćena PCR-om bez PCR-a. |
Statistika efikasnosti i prinosa izgradnje biblioteka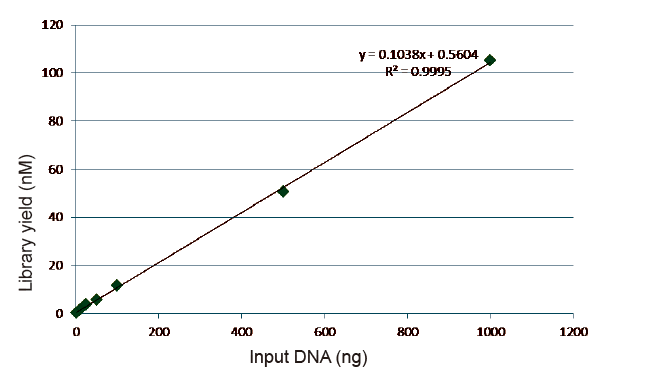 |
Slika 5. Rezultati kvantitativne analize bibliotečke DNK dobijene qPCR-om nakon izgradnje biblioteke metodom bez PCR-a za uzorke s različitim početnim količinama (1, 10, 25, 50, 100, 500,1000 ng). Linearna regresiona analiza pokazuje da prinos biblioteke ima dobar linearni odnos u širokom rasponu ulaznih podataka. Za unos DNK od samo 1 ng, efikasnost izgradnje biblioteke se ne smanjuje. |
Poređenje podataka o sekvenciranju različitih proizvoda
Trenutno se visokopropusna tehnologija sekvenciranja uglavnom temelji na tehnologiji sekvenciranja sljedeće generacije. Kako je dužina čitanja sljedeće generacije tehnologije sekvenciranja ograničena, moramo podijeliti niz cijele dužine u male biblioteke fragmenata u niz. U skladu s potrebama različitih eksperimenata sekvenciranja, obično biramo jednostruko ili dvostruko sekvenciranje. Trenutno se fragmenti DNK biblioteke za sekvenciranje sljedeće generacije općenito distribuiraju u rasponu od 200-800 bp.

a) DNK je loše kvalitete i sadrži inhibitore. Koristite visokokvalitetne uzorke DNK kako biste izbjegli inhibiciju aktivnosti enzima.
b) Količina uzorka DNK je nedovoljna kada se koristi metoda bez PCR-a za izgradnju DNK biblioteke. Kada unos fragmentirane DNK pređe 50 ng, tok rada bez PCR-a može se selektivno izvesti tokom procesa izgradnje biblioteke. Ako je broj kopije biblioteke prenizak da bi se mogao direktno sekvencirati, DNK biblioteka se može amplificirati PCR -om nakon ligacije adaptera.
c) Kontaminacija RNA dovodi do netačne početne kvantifikacije DNK Kontaminacija RNA može postojati u procesu prečišćavanja genomske DNK, što može dovesti do netačne kvantifikacije DNK i nedovoljnog učitavanja DNK tokom izgradnje biblioteke. RNA se može ukloniti tretiranjem sa RNazom.
A-1
a) Pojavljuju se mali fragmenti (60 bp-120 bp) Mali fragmenti su obično fragmenti adaptera ili dimeri nastali pomoću adaptera. Pročišćavanje pomoću magnetskih perlica Agencourt AMPure XP može učinkovito ukloniti ove fragmente adaptera i osigurati kvalitetu sekvenciranja.
b) Veliki fragmenti se pojavljuju u biblioteci nakon PCR amplifikacije. Veličina DNK fragmenta biblioteke će se povećati za 120 bp nakon ligacije adaptera. Ako se fragment DNK poveća za više od 120 bp nakon ligacije adaptera, to može biti uzrokovano abnormalnom amplifikacijom fragmenta zbog prekomjerne amplifikacije PCR -a. Smanjenje broja PCR ciklusa može spriječiti situaciju.
c) Nenormalna veličina DNK fragmenata biblioteke nakon ligacije adaptera Dužina adaptera u ovom kompletu je 60 bp. Kada se dva kraja fragmenta povežu s adapterima, dužina će se povećati samo za 120 bp. Kada koristite adapter koji nije priložen u ovom kompletu, obratite se dobavljaču radi pružanja relevantnih informacija, kao što je dužina adaptera. Molimo osigurajte da tijek rada i rad eksperimenta slijede korake opisane u priručniku.
d) Abnormalna veličina fragmenta DNK prije ligacije adaptera Razlog za ovaj problem može biti uzrokovan pogrešnim reakcijskim uvjetima tokom fragmentacije DNA. Za različit unos DNK treba koristiti različita vremena reakcije. Ako je unos DNA veći od 10 ng, preporučujemo da odaberete vrijeme reakcije od 12 minuta kao početno vrijeme za optimizaciju, a veličina fragmenta koji se tada proizvodi uglavnom je u rasponu od 300-500 bp. Korisnici mogu povećati ili smanjiti duljinu fragmenata DNK za 2-4 minute prema vlastitim zahtjevima kako bi optimizirali fragmente DNA potrebne veličine.
A-2
a) Vrijeme fragmentacije nije optimizirano Ako je fragmentirana DNK premala ili prevelika, pogledajte Smjernice za odabir vremena fragmentacije date u uputama za određivanje vremena reakcije i koristite ovu vremensku točku kao kontrolu, dodatno postavite reakcijski sistem za produženje ili skraćivanje 3 minute radi preciznijeg prilagođavanja vremena fragmentacije.
A-3
Abnormalna raspodjela DNK po veličini nakon tretmana fragmentacije
a) Netačna metoda odmrzavanja reagensa za fragmentaciju ili se reagens nije potpuno promiješao nakon odmrzavanja. Odmrznite 5 × reagens za miješanje fragmentacije na ledu. Nakon odmrzavanja, ravnomjerno promiješajte reagens laganim prelaskom po dnu epruvete. Ne vrtložite reagens!
b) Ulazni uzorak DNK sadrži EDTA ili druge zagađivače. Osiromašenje iona soli i sredstava za keliranje u koraku pročišćavanja DNK posebno je važno za uspjeh eksperimenta. Ako se DNK otopi u 1 × TE, koristite metodu navedenu u uputama za izvođenje fragmentacije. Ako je koncentracija EDTA u otopini neizvjesna, preporučuje se pročišćavanje DNA i njeno otapanje u deioniziranoj vodi radi kasnije reakcije.
c) Netačna početna kvantifikacija DNK Veličina fragmentirane DNK je usko povezana sa količinom unete DNK. Prije tretmana fragmentacije, tačna kvantifikacija DNK koristeći Qubit, Picogreen i druge metode je neophodna za određivanje tačne količine DNK u reakcionom sistemu.
d) Priprema reakcionog sistema ne slijedi upute Priprema fragmentiranog reakcionog sistema mora se izvesti na ledu strogo prema uputstvima. Kako bi se osigurao najbolji učinak, sve reakcijske komponente treba staviti na led, a pripremu reakcijskog sustava treba provesti nakon potpunog hlađenja. Nakon što je priprema završena, prelistajte ili pipetom dobro promiješajte. Ne vrtite!
1. Nepravilna metoda miješanja (vrtlog, snažne oscilacije itd.) Uzrokovat će abnormalnu raspodjelu fragmenata biblioteke (kao što je prikazano na sljedećoj slici), što će utjecati na kvalitetu biblioteke. Stoga, prilikom pripreme reakcijske otopine za fragmentacijsku mješavinu, lagano pipetirajte gore -dolje za miješanje ili upotrijebite vršak prsta da biste lagano listali i miješali. Pazite da se ne miješate s vrtlogom.

2. Za izgradnju biblioteke mora se koristiti DNK visoke čistoće
■ Dobar integritet DNK: Elektroforezna traka je veća od 30 kb, bez praćenja
■ OD260/230:> 1.5
■ OD260/280: 1,7-1,9
3. Količina unete DNK mora biti tačna Predlaže se korištenje Qubit i PicoGreen metoda za kvantifikaciju DNK, umjesto Nanodropa.
4. Sadržaj EDTA u otopini DNA mora se odrediti EDTA ima veliki utjecaj na reakciju fragmentacije. Ako je sadržaj EDTA visok, potrebno je provesti pročišćavanje DNK prije sljedećeg testa.
5. Reakcija reakcije fragmentacije mora se pripremiti na ledu. Proces fragmentacije je osjetljiv na temperaturu i vrijeme reakcije (posebno nakon dodavanja pojačivača). Kako biste osigurali tačnost vremena reakcije, pripremite reakcijski sistem na ledu.
6. Vrijeme reakcije fragmentacije mora biti tačno Vrijeme reakcije u koraku fragmentacije će direktno uticati na veličinu produkata fragmenata, utičući tako na distribuciju veličine DNK fragmenata u biblioteci.
1. Koja vrsta uzorka je primjenjiva na ovaj komplet?
Primjenjivi tip uzorka ovog kompleta može biti ukupna RNK ili pročišćena mRNK sa dobrim integritetom RNK. Ako se za izgradnju biblioteke koristi ukupna RNA, preporučuje se upotreba kompleta za iscrpljivanje rRNA (Cat#4992363/4992364/4992391) za prvo uklanjanje rRNA.
2. Mogu li se uzorci FFPE -a koristiti za izradu biblioteke s ovim kompletom?
MRNA u uzorcima FFPE -a bit će degradirana u određenoj mjeri, uz relativno loš integritet. Kada se ovaj komplet koristi za izgradnju biblioteke, preporučuje se optimiziranje vremena fragmentacije (skraćivanje vremena fragmentacije ili neizvođenje fragmentacije).
3. Koristeći korak odabira veličine koji je naveden u priručniku za proizvod, što može uzrokovati da umetnuti segment izgleda blago odstupanje?
Odabir veličine vrši se u skladu sa korakom odabira veličine u ovom priručniku za proizvod. Ako postoji odstupanje, razlog bi mogao biti u tome što magnetske kuglice nisu uravnotežene na sobnoj temperaturi ili nisu potpuno izmiješane, pipeta nije točna ili je tekućina ostala na vrhu. Za eksperiment se preporučuje korištenje vrhova s niskom adsorpcijom.
4. Izbor adaptera u izgradnji biblioteka
Komplet za izgradnju biblioteke ne sadrži adapterski reagens, pa se preporučuje upotreba ovog kompleta zajedno sa TIANSeq-ovim adapterom za jedan indeks (Illumina) (4992641/4992642/4992378).
5. QC biblioteke
Kvantitativno otkrivanje biblioteke: Qubit i qPCR se koriste za određivanje masene i molarne koncentracije biblioteke. Rad je strogo u skladu s priručnikom za proizvod. Koncentracija biblioteke općenito će zadovoljiti zahtjeve NGS sekvenciranja. Otkrivanje raspona distribucije biblioteka: Korištenje Agilent 2100 Bioanalyzera za otkrivanje raspona distribucije biblioteke.
6. Izbor broja ciklusa pojačanja
Prema uputama, broj ciklusa PCR-a je 6-12, a broj potrebnih ciklusa PCR-a treba odabrati prema unosu uzorka. U bibliotekama visokog prinosa dolazi do prekomjernog pojačanja u različitim stupnjevima, što se očituje nešto većim vrhom nakon vrha ciljnog raspona u detekciji bioanalizatora Agilent 2100, ili je otkrivena koncentracija Qubita niža od one u qPCR-u. Blago pojačavanje je normalna pojava koja ne utječe na sekvenciranje biblioteke i kasniju analizu podataka.
7. Šiljci se pojavljuju u profilu detekcije bioanalizatora Agilent 2100
Pojava šiljaka u detekciji bioanalizatora Agilent 2100 je posljedica neravnomjerne fragmentacije uzoraka, gdje će biti više fragmenata određene veličine, a to će postati očiglednije nakon obogaćivanja PCR -om. U ovom slučaju, predlaže se da se ne izvrši odabir veličine, tj. Da se podeli uslov fragmentacije na 94 ° C tokom 15 minuta inkubacije, gdje je raspodjela fragmenata mala i koncentrirana, a homogenost se može poboljšati.
Kategorije proizvoda
ZAŠTO ODABERITE NAS
Naša tvornica od svog osnutka razvija proizvode prve klase poštujući načelo
kvaliteta prije svega. Naši proizvodi stekli su odličnu reputaciju u industriji i vrijedno povjerenje među novim i starim kupcima.